中3化学 17年10月8日 / 最終更新日時 18年2月10日 進学研究室 中3化学 塾の見解 中3化学 イオン ①同じ濃度で体積を3倍にする ②同じ体積で濃度を2倍にする ③水を加えて体積を3倍にする。 中3化学 これだけは覚えたいイオン式まとめ 中学3年生で出てくるイオン式をまとめます。 電池や電気分解の理解にもつながるのでしっかり覚えてください。 数が多く大変ですが、何度も繰り返し声に出して読んでください。 知らぬ間に覚えられてい理科学習指導案(第3学年) える必要がある。水溶液の濃さと体積という二つの要素を基に、イオンのモデルを操作することで水 第10時 まとめ イオン数に着目した中 実験の結果とモデルを 観察、実験を行い、濃度

中3理科 化学変化とイオン 2学期期末テスト 赤城 ᐡᐤᐡ
中 3 理科 イオン 体積
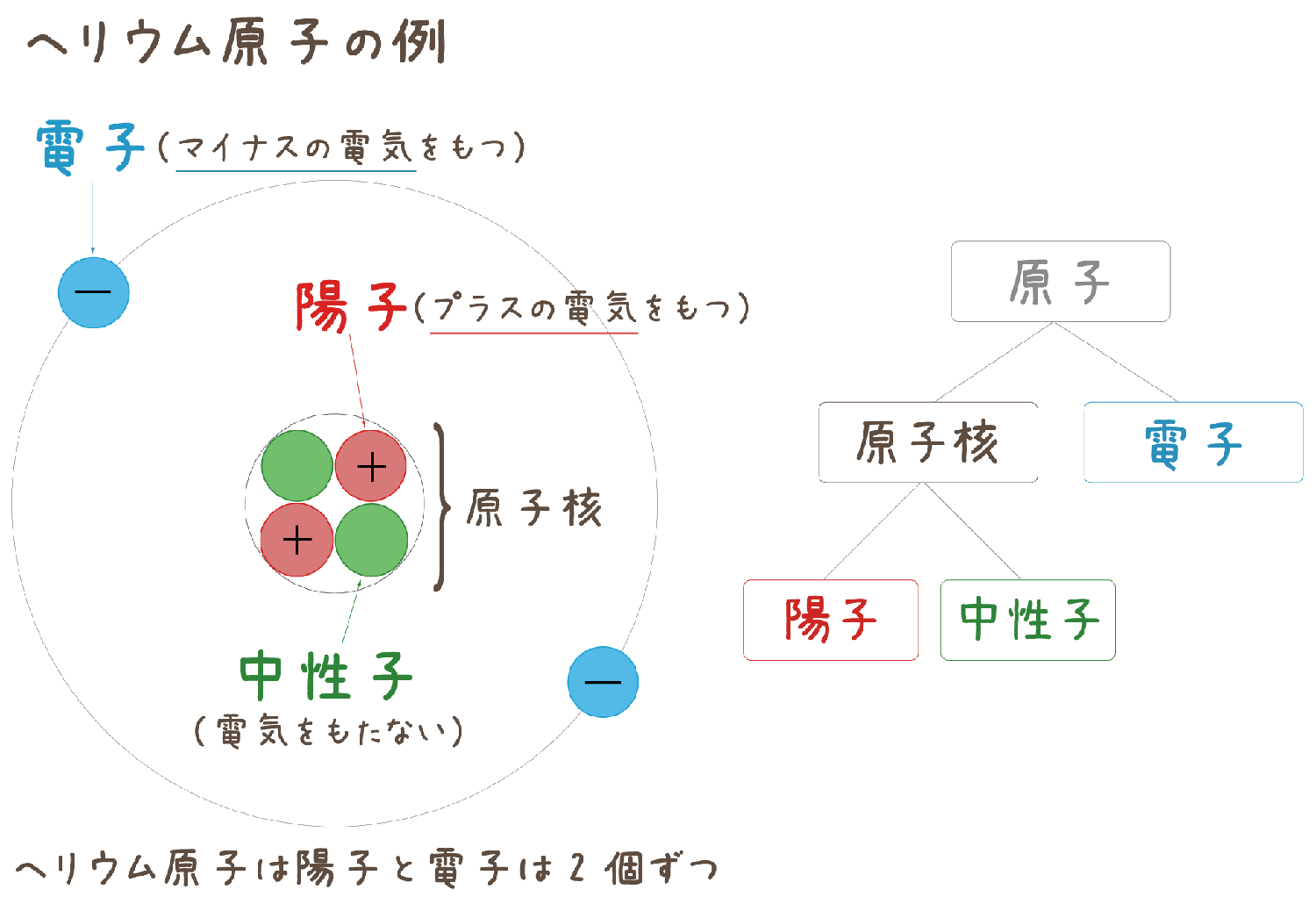
中 3 理科 イオン 体積-中学理科:水溶液とイオン、電気分解(基礎) ポイント すでに学習した水溶液や電気分解の話をよりくわしく学びます。 電気を通す水溶液は、実は 陽イオン と 陰イオン に分かれていること。 電気分解は、その水溶液中の陽イオン・陰イオンが 原子 にもどること。 そして、それらのカギをにぎるのは、 電子 の増減です。 1.原子の構造とイオン ①原子の 中3理科 原子の構造とイオンまとめと問題 原子の構造とイオンに関するまとめと問題です。 原子は陽子と中性子からなる原子核と、電子でできています。 陽子は+の電気、電子は-の電気を帯びていますが、原子は電気的に中性になります。 +の電気や



中3化学 中和の量的関係 中学理科 ポイントまとめと整理
中3理科 2学期以降 新出単元演習 水溶液とイオン① 基礎クラスは1⃣2⃣3⃣4⃣7⃣8⃣9⃣🔟をやれる範囲で解くこと。 問1 塩化銅が水に溶 と けてイオンに分かれるようすを,化学式とイオン式を使って表しなさい。 お問合せ 中3理科化学電池とイオンについて 理科の解説 TwitterFacebookLINE こんにちは、国分寺、小平の個別指導塾、こいがくぼ翼学習塾の川東です。 今日は、中学3年生の生徒が、理解にこまっている「電池とイオン」とくに、「電解質の水溶液の中の金属板と電流」の内容をお伝えします。 今日は以下の問題を例に説明していきます。 ★解き方★ 中3化学 イオン式の一覧を中学生向けに作成 しました。 さっそくイオン式の一覧を下に載せますが、 その下にはさらに、 化学式やイオン式の確認と解説 や イオン式の練習問題 も作ったので、ぜひ勉強に活用してください! 陽イオン 赤字がよく出る
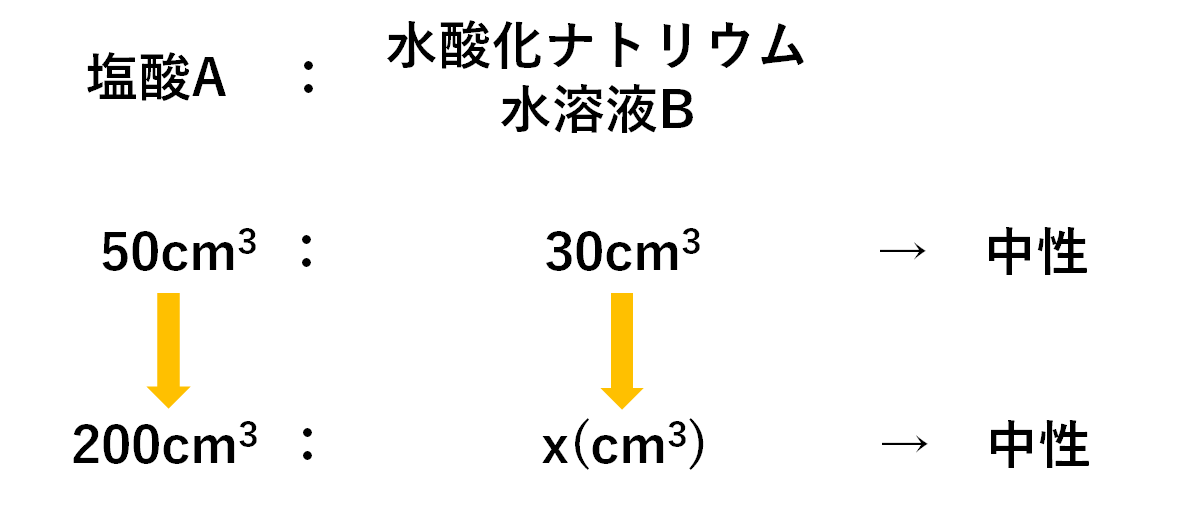
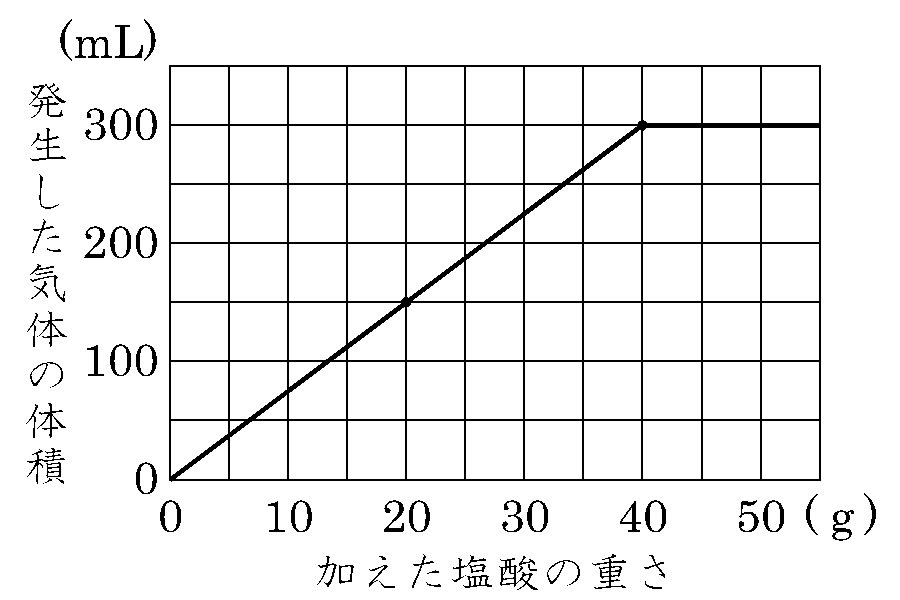
前期中間テスト 中3理科イオン・電気分解のコツとは?! 岐阜県各務原市の学習塾、ナビ個別指導学院鵜沼校のブログ紹介。小学生・中学生・高校生を対象にした英語・国語・数学・理科・社会などの勉強法や、中学受験・高校受験・大学受験の情報を紹介しています。答えは100cm 3 ② 塩酸の濃さを2倍にして体積も2倍になっているので、中のイオンの数は 4(倍) になっています。 中和するためのNaOH水溶液の体積も4倍必要です。 50(cm 3 )=0(cm 3 ) 答えは0cm 3 ③ 水でどれだけうすめても中のイオンの数はもとのまま(3) (1)のまわりに,電気を帯びた粒子が運動している。この粒子を何というか。 (4) (3)の粒子が帯びている電気の種類は,プラスかマイナスか。 (5) 原子の(2)①と(3)の粒子の数について,どのようなことがいえるか。 解答欄 (1) (2)①
You're signed out Videos you watch may be added to the TV's watch history and influence TV recommendations To avoid this, cancel and sign in to on your computer Cancel Confirm3 とイオン 化学変化と電池 水溶液の電気伝導性、中和反応、電池の仕組みをイオンモデルと関連付けて考 える。 校 校 種種 学 年 学習内容 単元の主な理科の着目する点 ・考え方 小 校 6 3 物と重さ 形や体積 重さを比較する イオンの濃度と体積の関係 中3の理科について質問です。 問題 濃度5%の塩酸cm3に 濃度7%の水酸化ナトリウム水溶液を15cm3加えると中性になった ①濃度10%の塩酸cm3の場合 濃度7%の水酸化ナトリウム水溶液は何cm3入れたら中性になるか →答えは 30cm3 ②濃度5%の塩酸40cm3の場合 濃度7%の水酸化ナトリウム水溶液は何cm3入れたら中性になるか →答




Junior High理科的 中3 理科 化学 水溶液とイオン 筆記 Clear



中3理科の中和と濃度体積の問題です 計算が苦手で分からないの Yahoo 知恵袋
3年27理科3化学変化とイオン(中和と塩)<基本問題> 組 番名前 水酸化ナトリウム水溶液と塩酸の中和を化学反応式で表すために,次のような手順で考えた。これ に関して,次の問いに答えなさい。 A水酸化ナトリウムの電離を式で表す。中3理科 中和とイオン数 中3理科 中和とイオン数 Watch later Share Copy link Info Shopping Tap to unmute If playback doesn't begin shortly, try restarting your 中3の理科について質問です。 問題 濃度5%の塩酸cm3に 濃度7%の水酸化ナトリウム水溶液を15cm3加えると中性になった (1)濃度10%の塩酸cm3の場合 濃度7%の水酸化ナトリウム水溶液は何cm3入れたら中性になるか →答えは 30cm3 (2)濃度5%の塩酸40cm3の場合 濃度7%の水酸化ナトリウム水溶液は何cm3入れたら中性になるか



1




綺麗な中3 理科 イオン 電気分解 最高のぬりえ
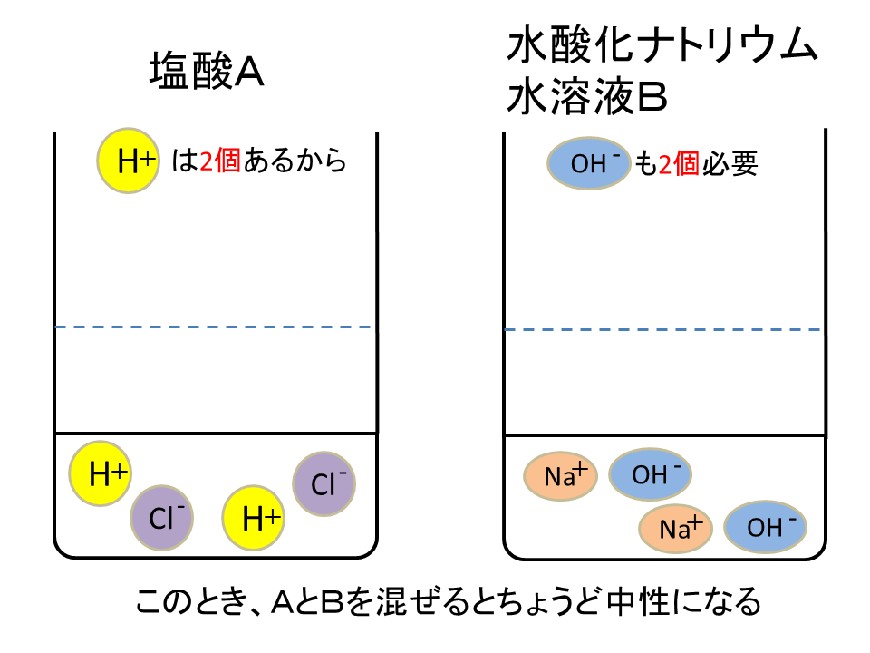
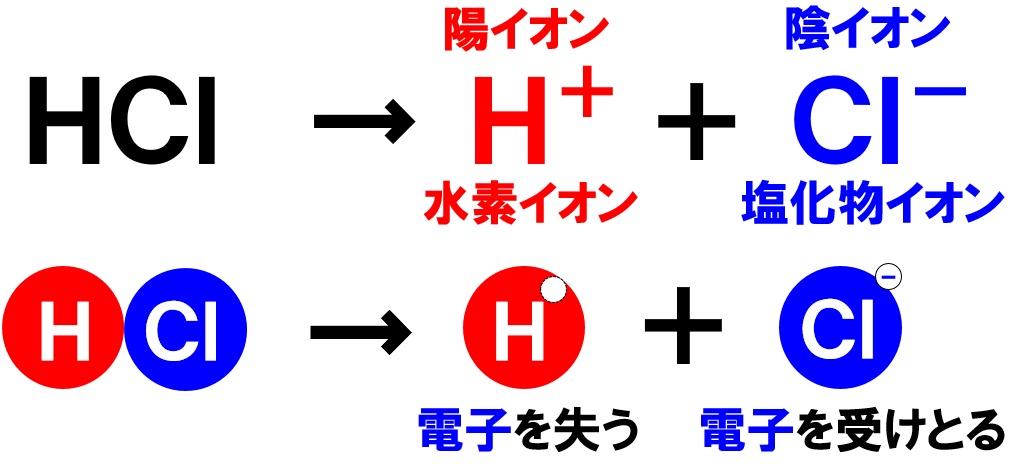
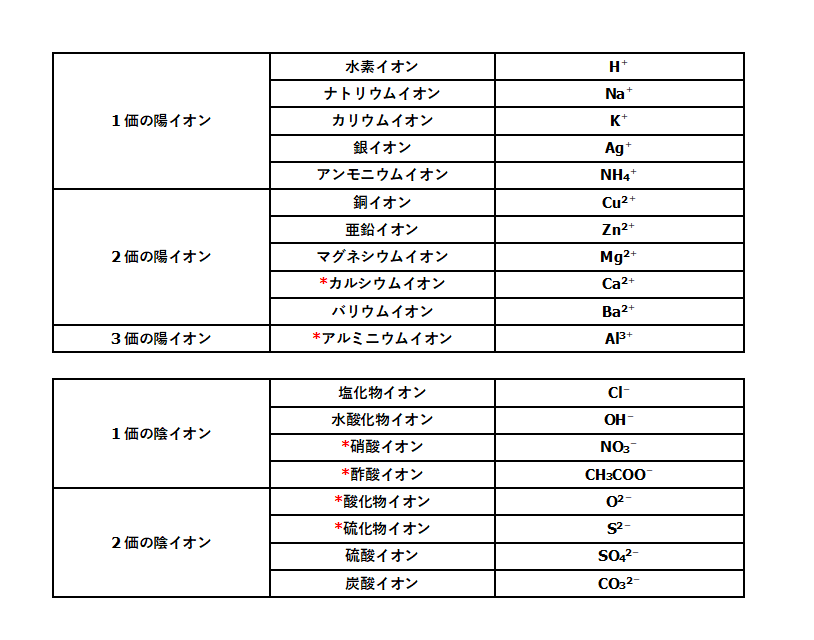
イオンとは 原子 が電気を帯びたものである。 原子が 電子 を失ってプラスの電気を帯びたものが 陽イオン である。 原子が 電子 を受け取ってマイナスの電気を帯びたものが 陰イオン である。 h 、oh − 、na 、s 2− などイオンを表す記号を イオン 式という。中3です。「電子のやり取り」の法則って? 中3です。「化学電池」のしくみが分かりません。 中3です。「酸性」「アルカリ性」とイオンの関係は? 中3です。「中和」の意味が分かりません。 中3 中3 理科 2学期 期始め・実力テスト 練習問題⑴ 1.図のような装置でうすい塩酸の電気分解を行うと,陽極と陰極からそれぞれ気体が発生した。 ⑴塩酸は塩化水素の水溶液である。 塩化水素が水溶液中で電離している様子を,化学式とイオン式を使って表せ。 ⑵陽極で発生した気体の名称を書け。 ⑶陽極側の気体の体積は,陰極側の気体の体積より少なかった



水溶液とイオン15 中和と塩 5終 水溶液のイオンの濃度と体積の関係 理科とか苦手で




中3 理科 酸 アルカリとイオン の単元です 3 の解き方が分かりません Clear
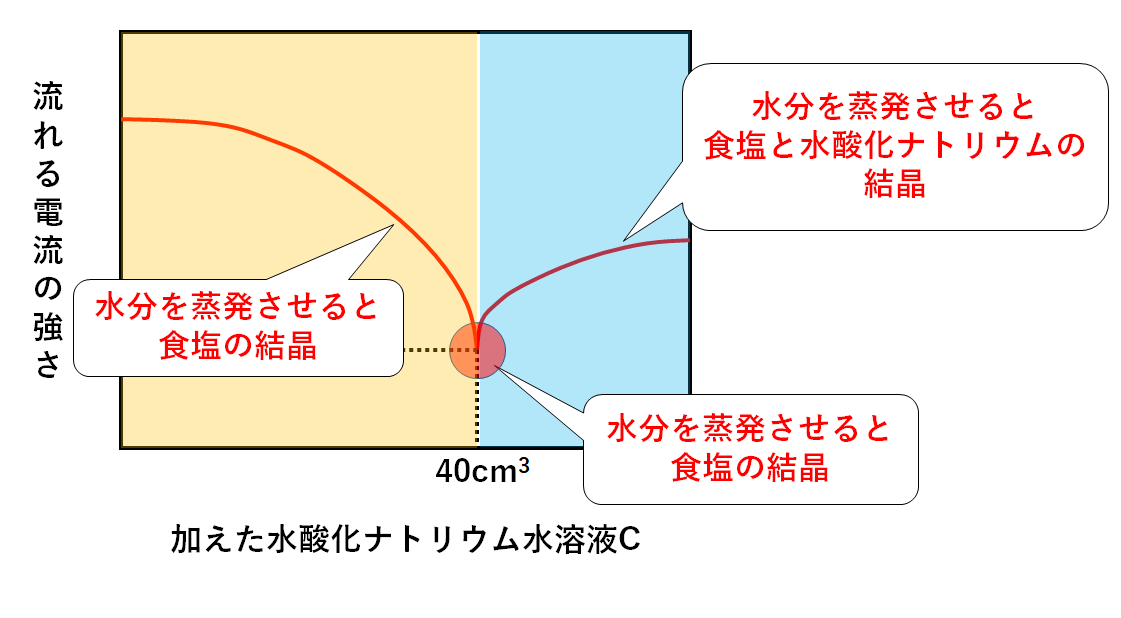
中3理科です。 中和の反応の単元で、水溶液中のイオンの総数と、水溶液の体積をグラフに表し、書くというものです。 見ずらいと思い、2枚に分けてしまいました💧正答は2枚目なのですが、それぞれのイオンが何個ずつあるのか、ということが、理解出来ず悩んでいます💦 2枚目の周りに色々書いてあるのは、現在私がメモ書きしたものです。 とくに中和が完了 中3理科 化学分野 電気分解 応用問題・計算問題 練習問題 今回は、食塩水や 硫酸銅 水溶液の 電気分解 について見ていく。 ※塩酸や塩化銅水溶液の 電気分解 が既習であるものとする。 前回 次回 例題1 いろいろな電気分解 例題2 食塩水の電気分解イオン式: Cl +( ) → ( ) 中学3 年理科 化学変化とイオン 第1章 水溶液とイオン③2「イオンと原子のなり立ち」電離について 前回は,原子が水溶液の中でどのように電気を帯びてイオンになるのかを学 習しました。



Fddata中学中間期末過去問集



中3化学 中和の量的関係 中学理科 ポイントまとめと整理
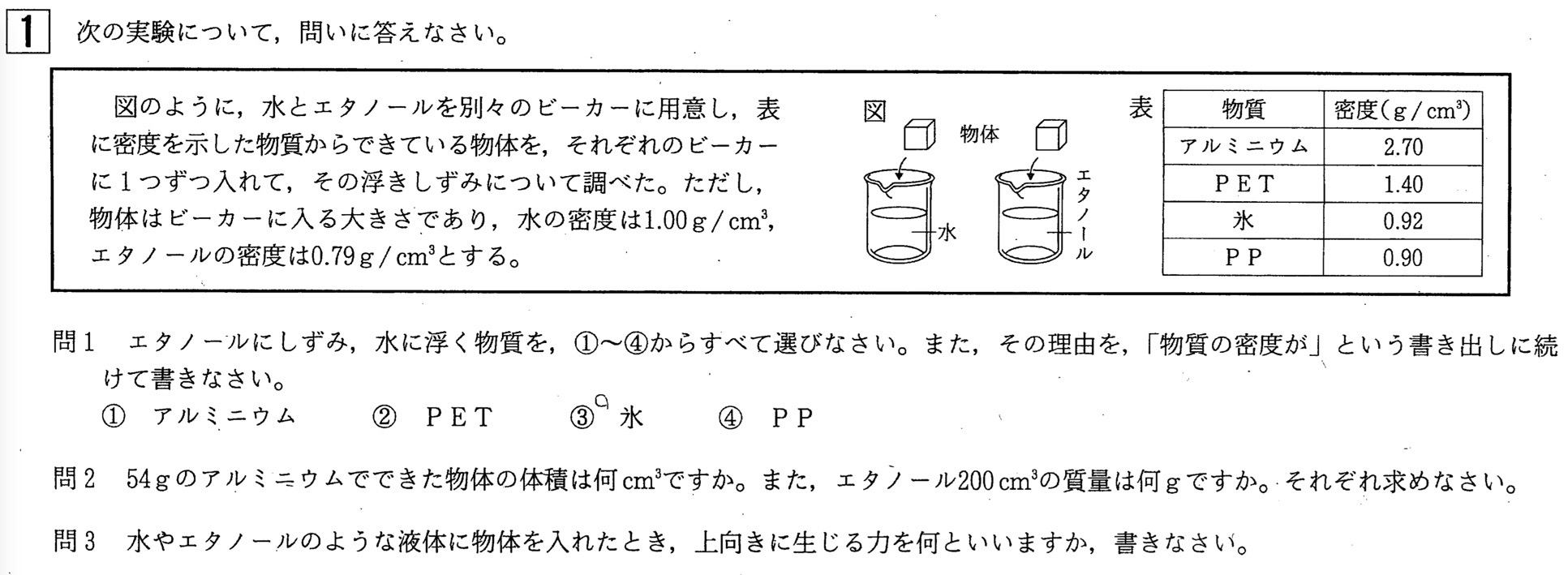
イの質量は800gで、体積は100㎤です。 密度は800÷100= 8(g/㎤) です。 ここで、以前の授業で話した食パンの話を思い出してください。なので、80×2=16 となります。 ⑵C液がの濃度が2倍になっただけで量は変わらないので⑴と同じように なので、80×2=16 となります。 ②⑴A液は水素イオンの数が15a個 B液は水酸化物イオンの数が2a個で、水酸化物イオンの方が多いのでアルカリ性です。 ⑵①の⑴よりB液16cm3で中和するのがA液cm3なので 0150=50cm3 なので、A液を50cm3加える となります。 ここまで 21年03月06日 185中3理科 イオンの覚え方 ~秀英iD予備校映像教師ブログ~ 皆さん、こんにちは! 近藤です。 今回は中3理科の化学分野で、よく出てくる イオンの覚え方についてです! 1価の陽イオン H (+)(水素イオン) K (+)(カリウムイオン)



中3理科 塩酸の電気分解のポイント Examee




中3理科 化学変化とイオン 2学期期末テスト 赤城 ᐡᐤᐡ
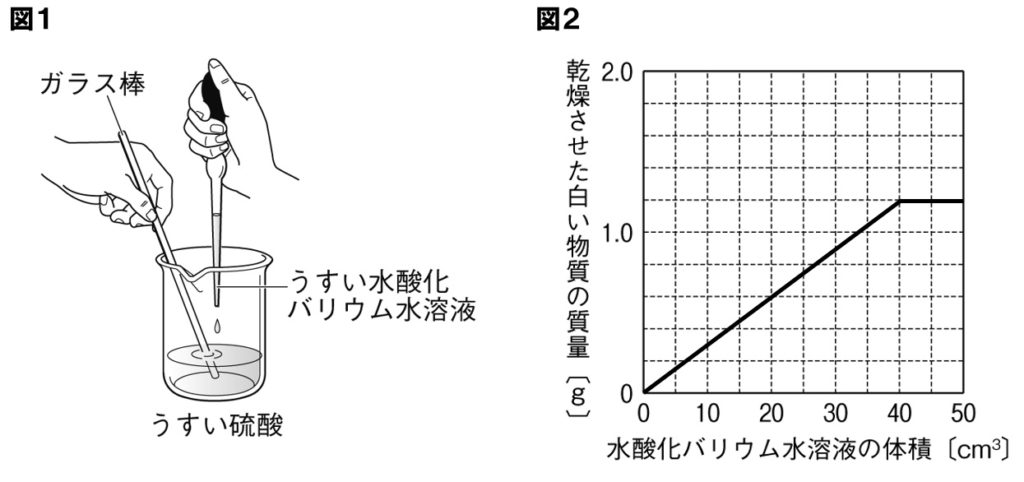
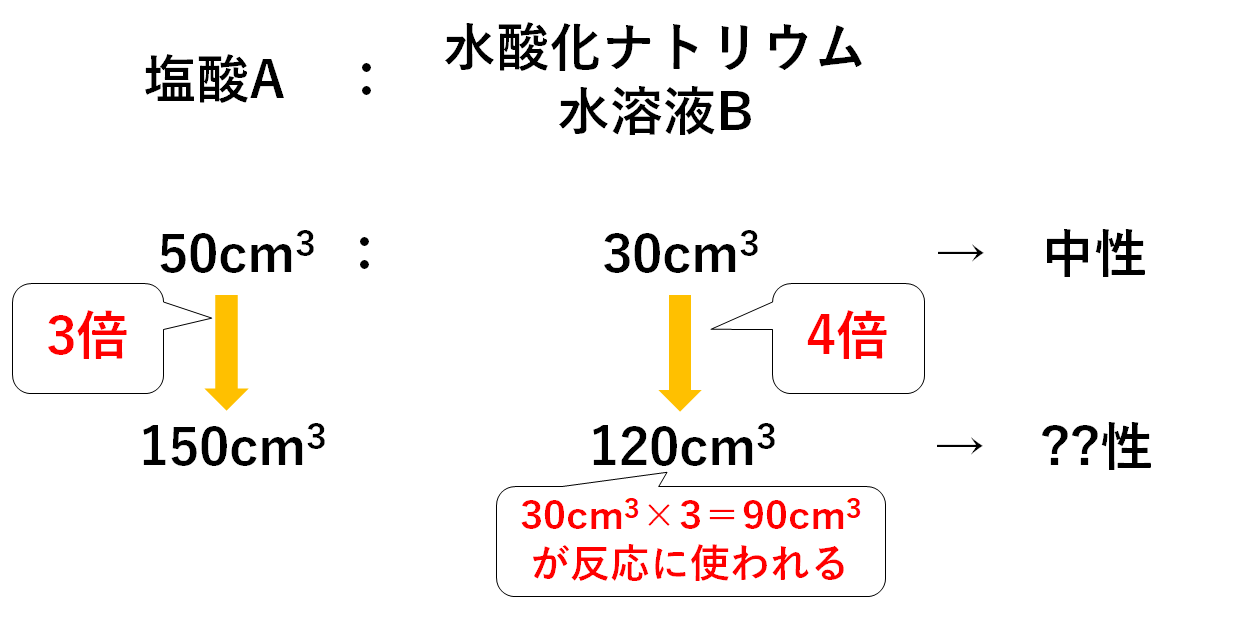
(4) 実験1の水酸化バリウム水溶液150cm 3 に水を混ぜて0cm 3 にしたので、1500=34 この比が同数のイオンを含む実験1と2の水酸化バリウム水溶液の体積比となる。 実験1で硫酸cm 3 に対して過不足なく反応した水酸化バリウム水溶液は30cm 3 であった。これと同数のイオンを含む実験2の水酸化バリウム水溶液をxとすると 中学3年理科。イオンと化学変化で登場するイオン化傾向を学習します。 レベル★★★☆ 重要度★★☆☆ ポイント:マグアルアエンテツドウ!授業用まとめプリントは下記リンクよりダウンロードしてください!授業用まとめプリント「イオン化傾向」イ イオンの濃度と体積の関係 中3の理科について質問です。 問題 濃度5%の塩酸cm3に 濃度7%の水酸化ナトリウム水溶液を15cm3加えると中性になった (1)濃度10%の塩酸cm3の場合 濃度7%の水酸化ナトリウム水溶液は何cm3入れたら中性になるか →答えは 30cm3 (2)濃度5%の塩酸40cm3の場合 濃度7%の水



中3化学 イオンとは 中学理科 ポイントまとめと整理




中和の計算問題 無料で使える中学学習プリント
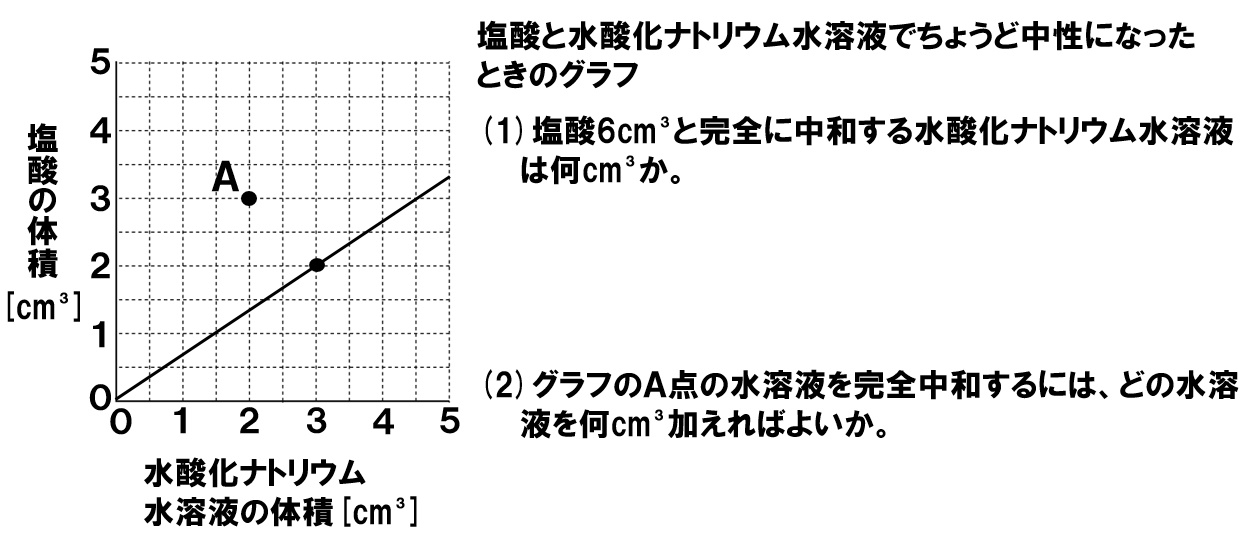
資料2:空気・水の学習内容系統 学習指導要領 理科 (小・中学校) 「空気」についての内容 小学第 3学年 風やゴムの働き ア風の力は,物を動かすことができること。 第 4学年 空気と水の性質中3理科。「酸性」「アルカリ性」がイオンで分かる? "水酸化物イオン"?? ぐはぁっ(ガクッ)倒れ込む中学生。立て、立つんだトォォォォ~ッ! オール5家庭教師、見参ッ!「酸性」「アルカリ性」が一発で分かるコツ!(ビシッ)見よ、プロの技。問4 2%の塩酸と水酸化ナトリウム水溶液が完全に中和するときの体積比は,上の表より,5:15=10:3である。 したがって,10:3=350: x という




至急お願いします 3の 3 でグラフ書く問題なのですが Clear



3
塩酸の体積はいつも80cm3。水酸化ナトリウム水溶液を 50cm3 加えたときに完全中和するから, 塩酸 + 水酸化ナトリウム水溶液 → 食塩 80cm 50cm 63 3 g となる。 〔塩酸80cm3〕 また,完全中和したあとには,水酸化ナトリウム水溶イオン式 理由 3 実験後、C液~F液の4種類の液をすべて混ぜ合わせた。この液を中性にするためには、水酸化 ナトリウム水溶液と塩酸のどちらを何cm3加えれば良いか。 を cm3加える。 霧島市「今週の1問」 (中3)(理科)(10)月(26)日版(a)H (b)Cl (c)OH (d)Na (e)NH 4 (f)Mg 2 (g)SO 4 2 (h)NO 3A 陽極から発生する塩素は水に溶けやすいので、気体の体積の少ないAから発生しているのが塩素と考えられるから。 陰極の気体(a,e,g,j) 陽極の気体(f,h,i) 2HCl→H 2 Cl 2



共通テストに出ます 中学三年理科 グラフ 1 べんきょうなせん W



中3理科の学習ポイント 今すぐニガテを克服しよう 家庭教師ジャニアス
中3理科で学ぶ「中和とイオン」のテストによく出る問題(中和とイオン)を学習しよう! 酸・アルカリと中和の問題を見る > すべての授業の「要点まとめノート」「問題・解答」をPDF無料ダウンロードできる 学校で使っている教科書にあわせて勉強できる わからないところを質問できる 会員登録をクリックまたはタップすると、 利用規約・プライバシー溶液中の( ③ )イオンが、移動してきた電子を受けとり( ③ )原子となり、その原子が( ④ )個結 びついて分子となって金属板の表面から発生する。中3理科「化学変化とイオン」がわからない人は、以下の順でTry ITの映像授業を観て勉強してみてください。 「原子とイオン」に関する3のポイントを覚える 「電気分解と電池」に関する3のポイントを覚える 「酸・アルカリと中和」に関する4のポイントを覚える まずはこれらのポイントをしっかり覚えてから、練習にある問題を解いて「化学変化とイオン」の



中3理科 中和の計算問題 Examee




中和の計算問題 無料で使える中学学習プリント




中3理科 イオン 酸とアルカリ 中和まとめと問題



中3理科の学習ポイント 今すぐニガテを克服しよう 家庭教師ジャニアス



濃度と体積
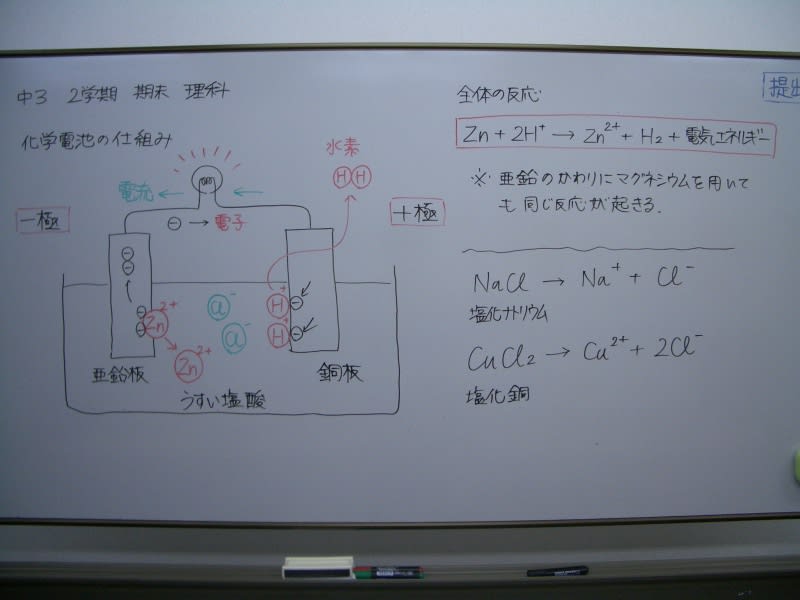



中3理科 期末テスト 化学電池の問題 ブログ アビット




綺麗な中3 理科 イオン 電気分解 最高のぬりえ




理科 中3 16 動物の生殖 Youtube




イオン式 学習 テスト問題 中学理科の無料学習プリント Yattoke プリント カード




中3化学 中和の量的関係 沈殿が生じる場合 中学理科 ポイントまとめと整理




理科 3 平成31年度埼玉県公立高校入試問題予想 埼玉新聞




中3理科 化学変化とイオン 2学期期末テスト 赤城 ᐡᐤᐡ




ボード 学習ノート のピン




中1理科 メスシリンダーの使い方 映像授業のtry It トライイット




中3化学 中和の量的関係 中学理科 ポイントまとめと整理
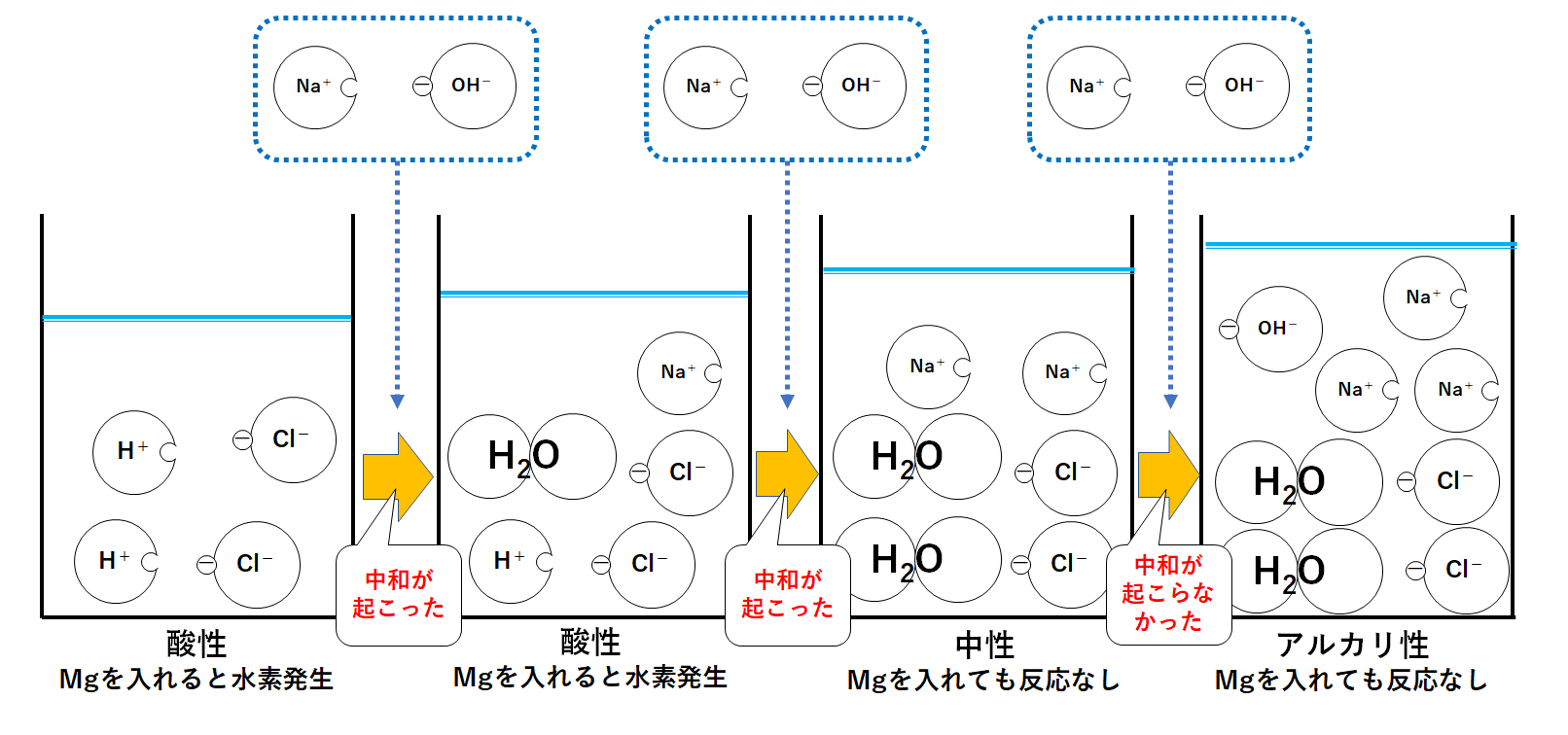



中3化学 中和反応 中学理科 ポイントまとめと整理




取り出した10cm3の中の水素イオンの比が4 9になるみたいなんですけどなんでですか Clear




中学3 理科 イオンのグラフ 下の写真のやり方が分かりません どのよう Okwave



中3理科 イオン これは他の人のノートなのですが赤文字で Yahoo 知恵袋




中3理科 完全中和の計算 Pikuu




中学3年中和と濃度 体積の計算について 大問1と2はかろうじて理解出 中学校 教えて Goo



中3理科の学習ポイント 今すぐニガテを克服しよう 家庭教師ジャニアス




中3理科ワークシート 単元5地球と宇宙 地学分野




中3理科 イオン 酸とアルカリ 中和まとめと問題




水溶液とイオン15 中和と塩 5終 水溶液のイオンの濃度と体積の関係 理科とか苦手で



年過去問 中学3年北海道学力テスト総合a 理科 の問題 解答 答え 詳しい解説を全て公開します 家庭教師のsora




綺麗な中3 理科 イオン 電気分解 最高のぬりえ




中1理科 密度の単位と計算方法 練習編1 映像授業のtry It トライイット




中1理科 密度の表し方 映像授業のtry It トライイット




中3 中3化学 化学変化とイオン 中学生 理科のノート Clear



中三理科の中和の濃度と体積の問題です 大問4が答えの解説を見てもわか Yahoo 知恵袋



濃度と体積




高校入試 中3理科 中和とイオン エネルギー 天体 実力テスト用



中3理科中和計算問題です 全くわかりません 大問2と大問3です Yahoo 知恵袋




中学理科 電気分解 を得意分野に 高校入試もバッチリな勉強法 高校入試徹底対策ガイド



中3理科中和と濃度体積の問題です 助けてください 大問1の 1 しかわかりませ Yahoo 知恵袋




理科の偉人一覧 中学生向け



中3化学 中和の量的関係 中学理科 ポイントまとめと整理




水溶液とイオン15 中和と塩 5終 水溶液のイオンの濃度と体積の関係 理科とか苦手で




塩化銅水溶液の電気分解をしよう 中学理科3年生 オペラだって あんたがたどこさブログ



3




中3理科 完全中和の計算 Pikuu




イオン 中和の問題です 中3理科の定期テスト対策 カシマブログ 名古屋の学習塾 鹿島塾



中3理科 燃料電池のポイント Examee




驚くばかり中3 理科 イオン式 最高のぬりえ




理科 中3 16 動物の生殖 Youtube




中2 理科 中2 3 水に電流を流す Youtube



中3理科 完全中和の計算 Pikuu




2 と 3 教えてほしいです ᴗ ˬᴗ Clear
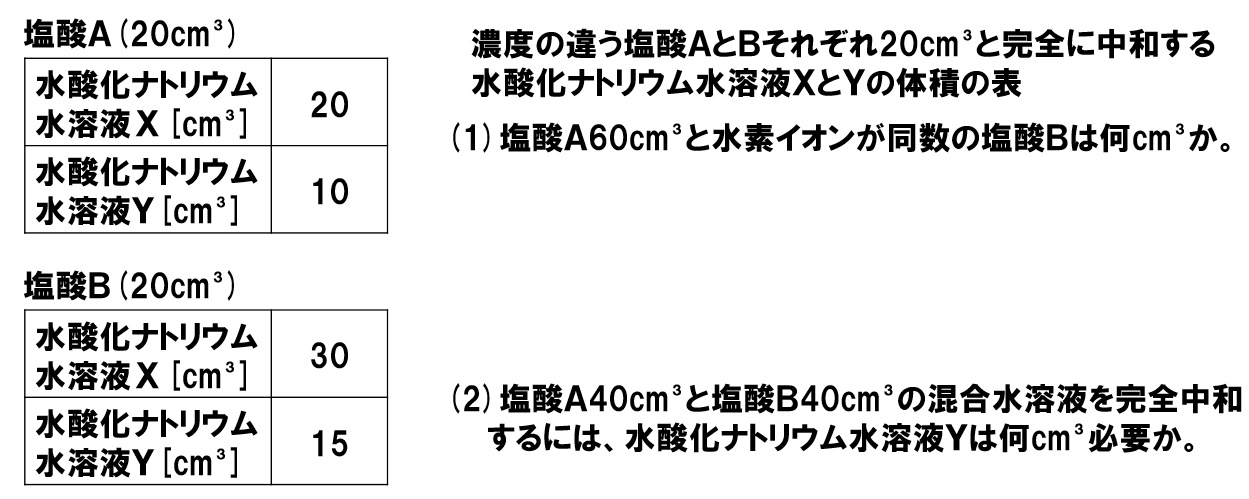



中3理科 完全中和の計算 Pikuu




綺麗な中3 理科 イオン 電気分解 最高のぬりえ



中3理科の問題です 水酸化ナトリウム水溶液にうすい塩酸を少量ずつ加えるという問 Yahoo 知恵袋




綺麗な中3 理科 イオン 電気分解 最高のぬりえ
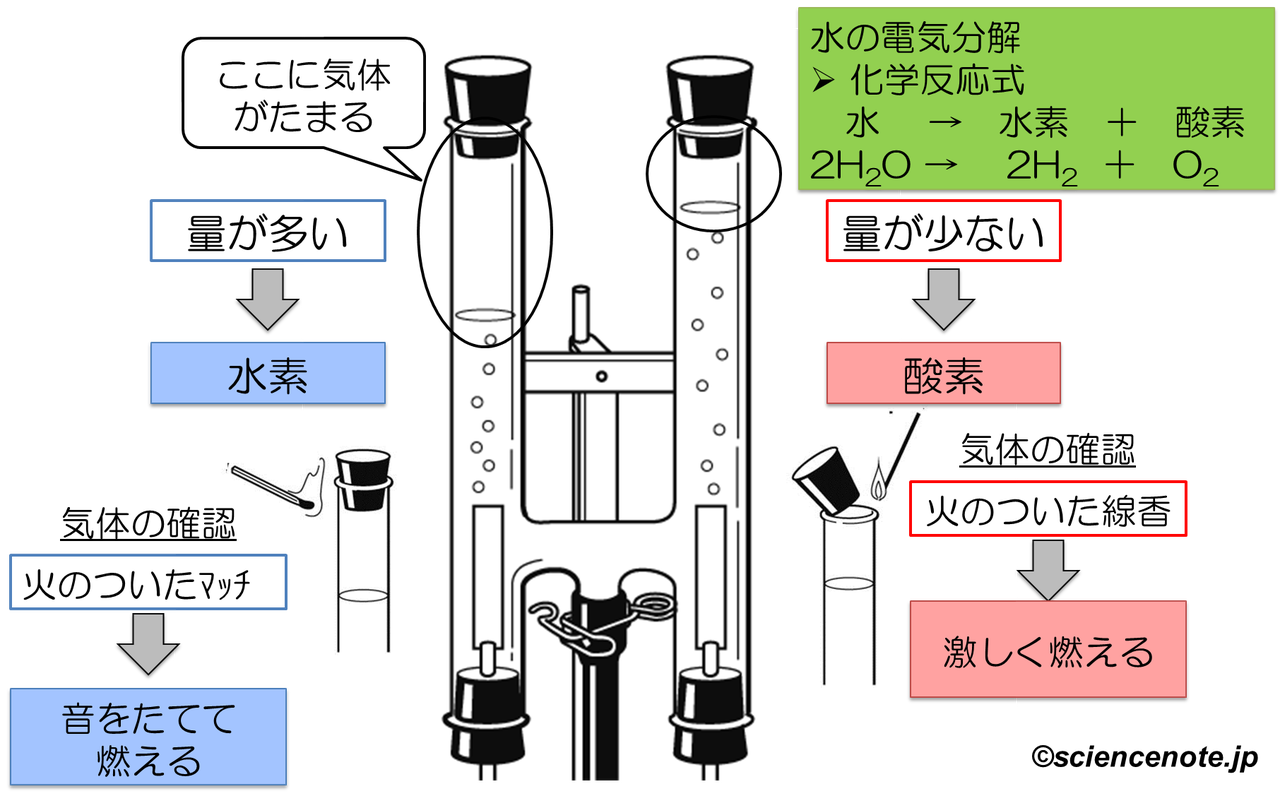



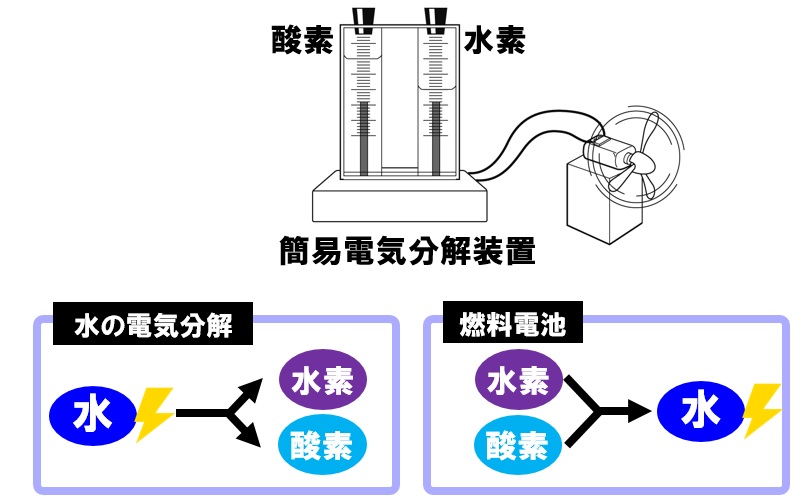
中2化学 水の電気分解 Sciencenote Jp



中3理科 中和の計算問題 Examee



中3理科 イオンの勉強で色々ややこしくなってしまったのでまとめたのですが Yahoo 知恵袋



Center Esnet Ed Jp Wysiwyg File Download 22 4500




綺麗な中3 理科 イオン 電気分解 最高のぬりえ




上理科 問題 中学 最高のぬりえ



中三理科の中和の濃度と体積の問題です 大問4が答えの解説を見てもわか Yahoo 知恵袋




中3理科ワークシート 単元5地球と宇宙 地学分野
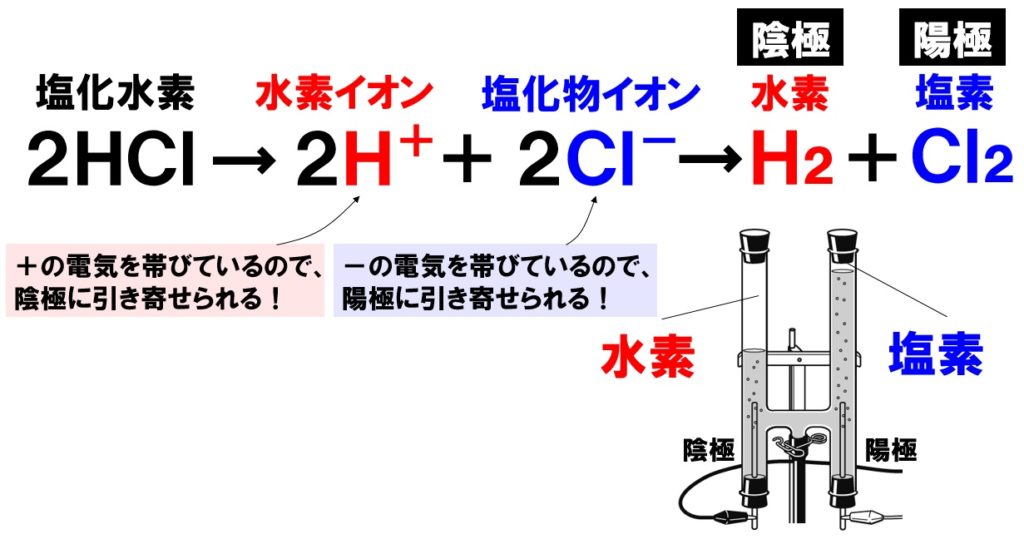



中3理科 塩酸の電気分解のポイント Examee




理科 3 平成31年度埼玉県公立高校入試問題予想 埼玉新聞
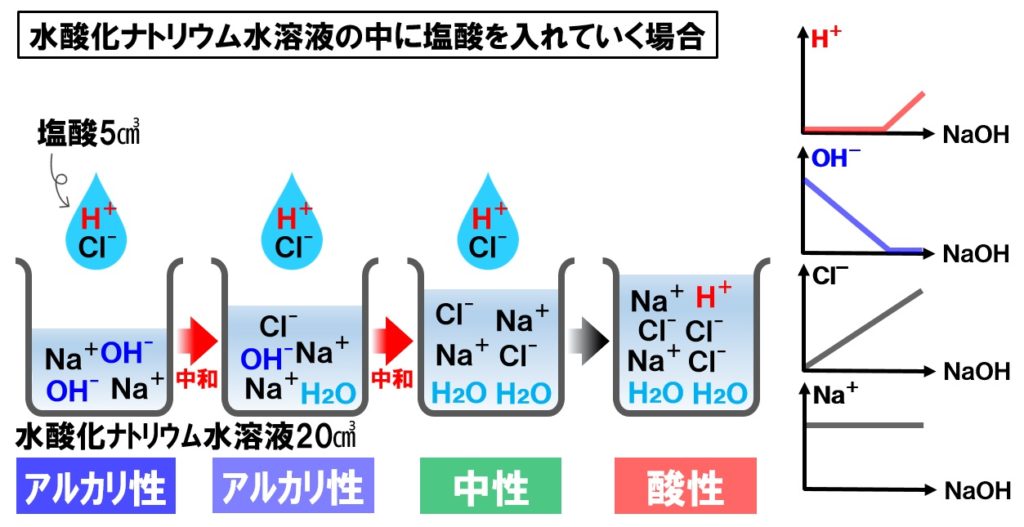



中3理科 中和の実験 イオン数のグラフのポイント Examee




マイスタディガイド 中学理科
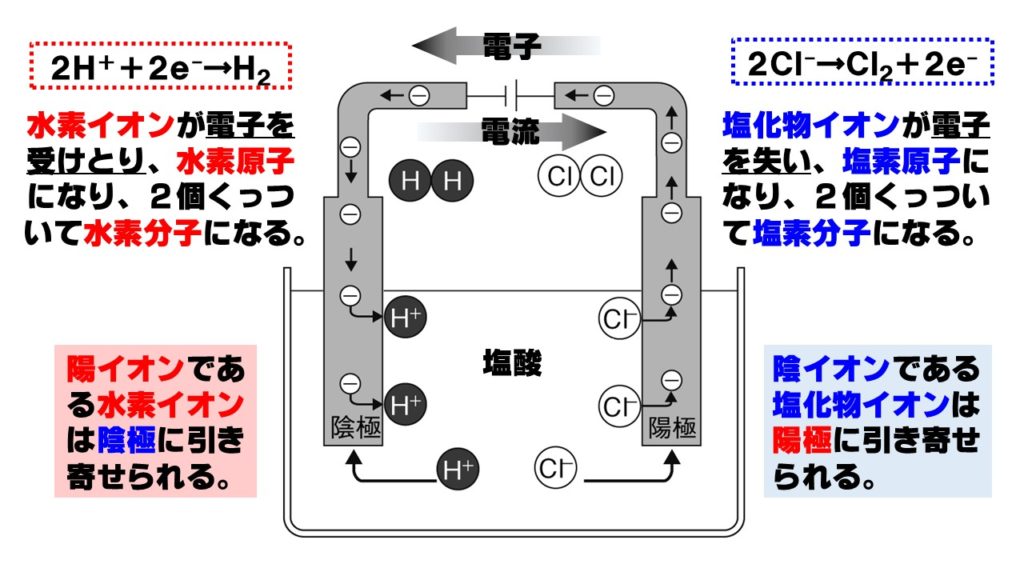



中3理科 塩酸の電気分解のポイント Examee



中3理科の科学の計算です 1 をお願いしますなぜ 塩酸の Yahoo 知恵袋




至急お願いします 3の 3 でグラフ書く問題なのですが Clear




高校化学基礎 中和の量的関係 映像授業のtry It トライイット




中3理科です 中和の反応の単元で 水溶液中のイオンの総数と 水溶液の体積をグラフに表 Clear




中3 理科 中3 33 太陽系の天体 Youtube



濃度と体積




ボード 学習ノート のピン
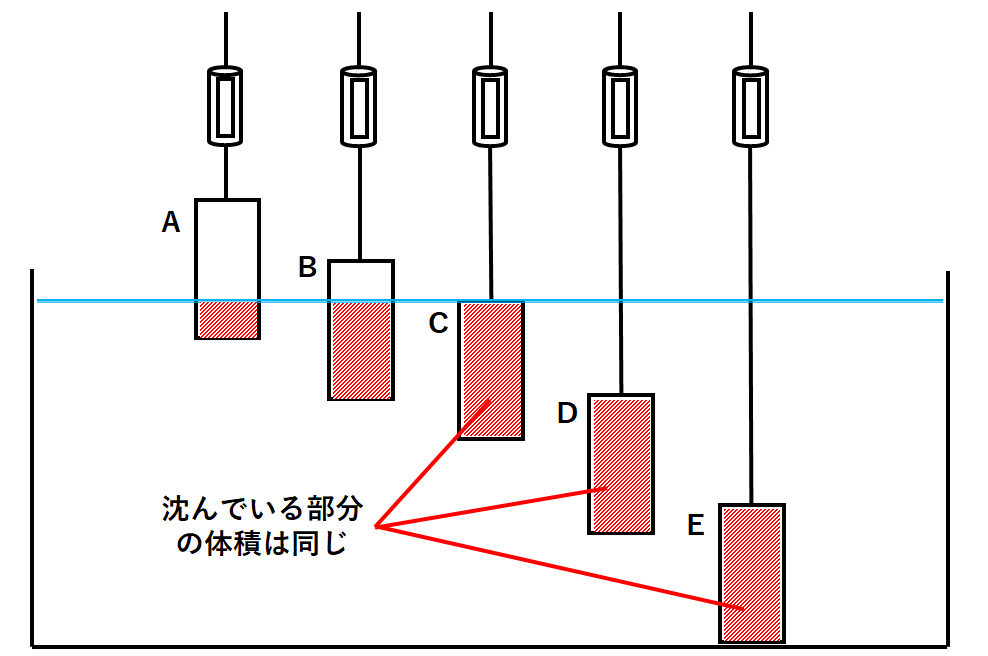



中1物理 浮力とは 中学理科 ポイントまとめと整理



3




中3理科の学習ポイント 今すぐニガテを克服しよう 家庭教師ジャニアス




中3 理科 化学 中和とイオン 20分 Youtube
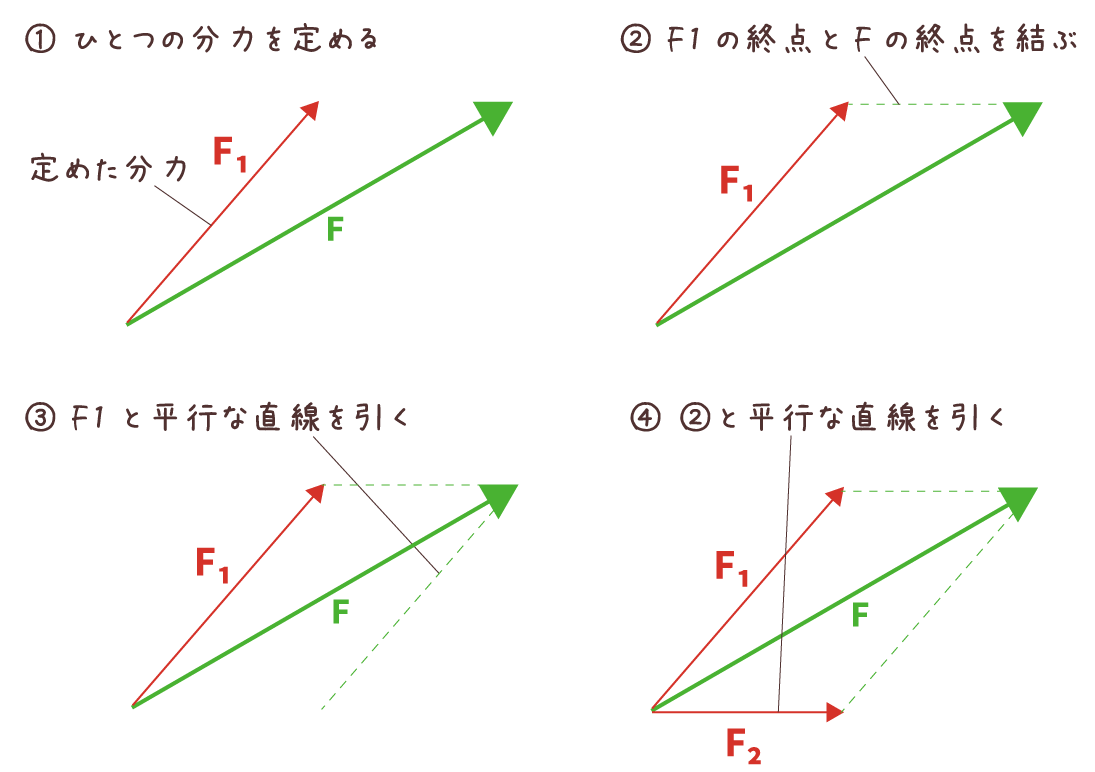



中3理科の学習ポイント 今すぐニガテを克服しよう 家庭教師ジャニアス




綺麗な中3 理科 イオン 電気分解 最高のぬりえ




中1理科基本問題集 単元2物質のすがた 化学分野




綺麗な中3 理科 イオン 電気分解 最高のぬりえ




中3化学 水の電気分解 中学理科 ポイントまとめと整理
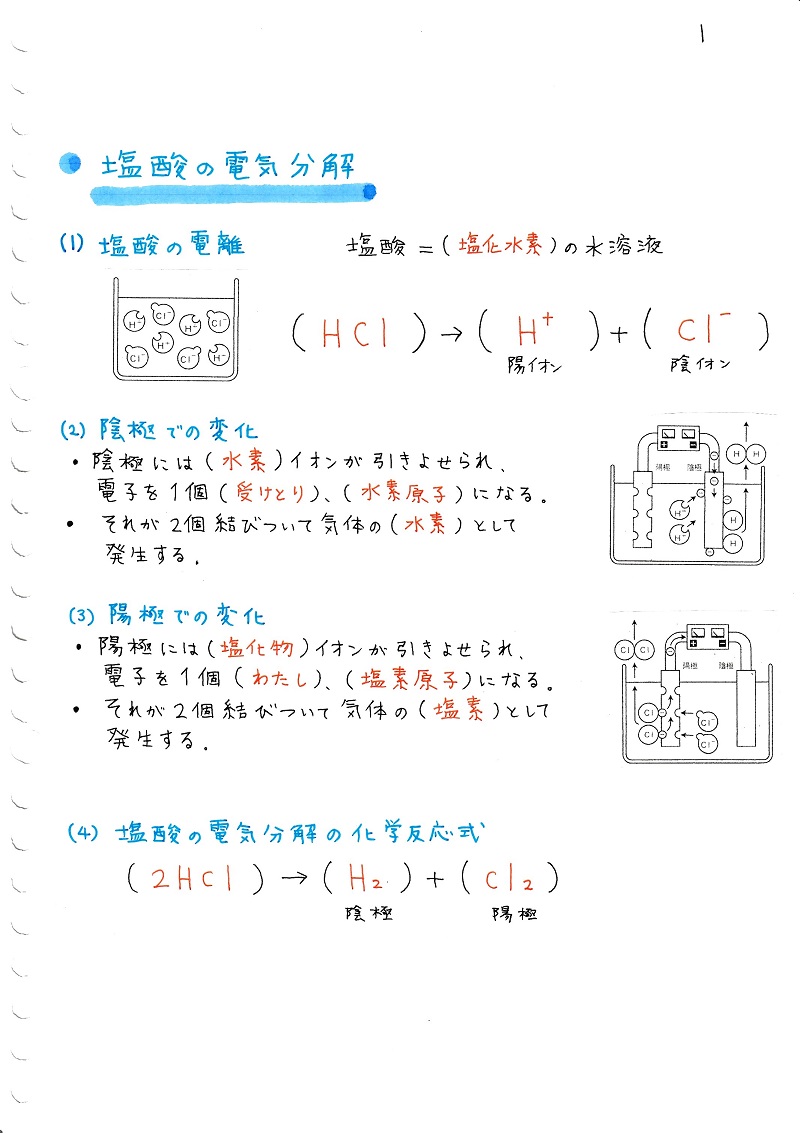



中学理科 水溶液とイオン4 まとめ編 ママ塾ノート




中1理科基本問題集 単元2物質のすがた 化学分野




綺麗な中3 理科 イオン 電気分解 最高のぬりえ




中学理科の重要用語まとめ 高校入試よく出る編 中学生勉強サイトあかね先生




理科の中和と濃度 体積の所なんですけどよく分かんないです Clear




中3理科 定期テスト範囲 中和 ブログ アビット



0 件のコメント:
コメントを投稿